Proizvod rastvorljivosti je tip dinamičke ravnoteže. On postoji kad je čvrsto hemijsko jedinjenje u hemijskoj ravnoteži sa rastvorom tog jedinjenja. Čvrsta materija se može rastvoriti nepromenjena, uz disocijaciju ili putem hemijske reakcije sa nekim od sastojaka rastvarača, kao što su kiseline ili baze. Svaki tip ekvilibrijuma ima karakterističnu konstantom ravnoteže koja je zavisna od temperature.[1][2][3] Proizvodi rastvorljivosti su važni farmaceutskim, ekološkim i mnogim drugim scenarijima.
Do ravnotežne rastvorljivosti dolazi kad je hemijsko jedinjenje u čvrstom stanju u hemijskoj ravnoteži sa rastvorom tog jedinjenja. Ova ravnoteža je primer dinamičke ravnoteže u smislu da individualni molekuli migriraju između čvrste i tečne faze tako da su brzine sovatacije i precipitacije međusobno jednake. Kad se ravnoteža uspostavi za rastvor se kaže da je zasićen. Koncentracija rastvorka u zasićenom rastvoru je poznata kao rastvorljivost. Jedinice rastvorljivosti mogu da budu molarne(mol dm−3) ili izražene kao masa po jedinici zapremine, kao što je μg ml−1. Rastvorljivost je zavisna od temperature. Rastvor koji sadrži veću koncentraciju rastvorka od njegove rastvorljivosti se naziva superzasićenim. Superzasićeni rastvor se može indukovati da pređe u ravnotežu dodatkom „semena“, što mogu da budu mali kristal rastvorka, ili nekog drugog praha, čime se inicira precipitacija.
Postoje tri glavna tipa ravnoteže rastvorljivosti.
- Jednostavno rastvaranje.
- Rastvaranje sa disocijacijom. Ovo je karakteristično za soli. Konstanta ravnoteže je poznata u ovom slučaju kao proizvod rastvorljivosti.
- Rastvaranje sa reakcijom. Ovo je karakteristično za rastvaranje slabih kiselina ili slabih baza u vodenoj sredini promenljive pH vrednosti.
U svakom od ovih slučaja konstanta ravnoteže se može definisati kao odnos aktivnosti. Ova konstanta ravnoteže nema dimenzije. Međutim, upotreba aktivnosti je veoma nepodesna, tako da se konstanta ravnoteže obično deli količnikom koeficijenata aktivnosti, da postane količnik koncentracija. Koncentracija rastvarača se obično uzima da je konstantna, tako da se ona uključuje u konstantu ravnoteže. Iz tih razloga konstanta proizvoda rastvorljivosti ima dimenzije koje se odnose na razmere u kojima su koncentracije merene. Proizvod rastvorljivosti se definiše u smislu koncentracija koje su ne samo zavisne od temperature, nego isto tako zavise i od sastava rastvarača, posebno u slučajevima kad rastvarač sadrži dodatne sastojke.
Ravnoteža se definiše za for specifičnu kristalnu fazu. Stoga se očekuje da proizvod rastvorljivosti bude različit u zavisnosti od faze čvrste materije. Na primer,aragonit i kalcit imaju različite proizvode rastvorljivosti mada oni imaju istu hemijsku strukturu (kalcijum karbonat). Ipak, pod datim uslovima, najverovatnije je da je samo jedna faza je termodinamički stabilna, i zbog toga ta fazi formira pravu ravnotežu.
Konstanta termodinamičke rastvorljivosti se definiše za velike monokristale. Rastvorljivost će porasti sa smanjenjem veličine čestica rastvorka (ili kapljica) zbog dodatne površinske energije. Ovaj uticaj je generalno mali osim ako su čestice veoma male, tipično manje od 1 μm. Uticaj veličine čestica na konstantu rastvorljivosti se može kvantifikovati na sledeći način:
gde je  konstanta ratvorljivosti za čestice rastvorka sa molarnom površinom A,
konstanta ratvorljivosti za čestice rastvorka sa molarnom površinom A, 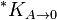 je konstanta rastvorljivosti za supstance sa molarnom površinom koja teži nuli (i.e., kad su čestice velike), γ je površinski napon čestica rastvorka u rastvaraču, Am je molarna površina rastvorka (u m²/mol), R je univerzalna gasna konstanta, i T je apsolutna temperatura.[4]
je konstanta rastvorljivosti za supstance sa molarnom površinom koja teži nuli (i.e., kad su čestice velike), γ je površinski napon čestica rastvorka u rastvaraču, Am je molarna površina rastvorka (u m²/mol), R je univerzalna gasna konstanta, i T je apsolutna temperatura.[4]
Uticaj soli[5] se odnosi na činjenicu da prisustvo soli koje nemaju zajednički jon sa rastvorkom utiče na jonsku jačinu rastvora i otuda na koeficijent aktivnosti, tako da se konstanta ravnoteže, izražena kao količnik koncentracija, menja.
Rastvorljivost je senzitivna na promene temperature. Na primer, šećer je rastvorniji u toploj vodi nego u hladnoj. Do toga dolazi zato što su konstante rastvorljivosti, poput drugih tipova ravnotežnih konstanti, su funkcije temperature. U skladu sa Le Šateljeovim principom, kad je solvatacioni proces endoterman (toplota se apsorbuje), rastvorljivost raste sa porastom temperature, dok kad je proces egzoterman (toplota se oslobađa) rastvorljivost opada sa povišenjem temperature.[6] Uticaj temperature je osnova procesa rekristalizacije, koji se koriste za prečišćavanje hemijskih jedinjenja.
Natrijum sulfat pokazuje povišenu rastvorljivost na temperaturama ispod 32.4 °C, a smanjenu rastvorljivost na višim temperaturama.[7] Do toga dolazi zato što je čvrsta faza dekahidrat, Na2SO4.10H2O, ispod tačke tranzicije, a različiti hidrat iznad te temperature.
U kondenzovanim fazama (čvrstoj i tečnoj), zavisnost rastvorljivosti od pritiska je tipično neznatna, i obično se ne uzima u obzir. Pretpostavljajući postajanje idealnog rastvora, ova zavisnost se može kvantifikovati kao:
gde indeks i odgovara komponentama, Ni je molarna frakcija i-te komponente rastvora, P je pritisak, indeks T označava konstantnu temperaturu, Vi,aq je parcijalna molarna zapremina i-te komponente rastvora, Vi,cr je parcijalna molarna zapremina i-te komponente rastvorene čvrste materije, i R je univerzalna gasna konstanta.[8]
Rastvaranje organskih jedinjenja se može opisati kao ravnoteža između supstance u čvrstom i rastvorenom stanju. Na primer, kad saharoza (stoni šećer) formira zasićeni rastvor
 .
.
Jednačina ravnoteže ove reakcije se može napisati kao količnik koncentracija produkta i reaktanta:
gde se K![]() naziva termodinamička konstanta rastvorljivosti. Zagrade označavaju aktivnost. Aktivnost čiste čvrste materije je, po definiciji, jedinica. Stoga je
naziva termodinamička konstanta rastvorljivosti. Zagrade označavaju aktivnost. Aktivnost čiste čvrste materije je, po definiciji, jedinica. Stoga je
Aktivnost supstance, A, u rastvoru se može izraziti kao proizvod koncentracije, [A], i koeficijent aktivnosti, γ. Kad se K![]() podeli sa γ konstantom rastvorljivosti dobija se Ks,
podeli sa γ konstantom rastvorljivosti dobija se Ks,
Ova je ekvivalentno sa definisanjem standardnog stanja kao zasićeni rastvor, tako da je koeficijent aktivnosti jednak jedinici. Konstanta rastvorljivosti je zaista konstanta samo ako na koeficijent aktivnosti ne utiče prisustvo bilo kojeg drugog rastvorka. Jedinica konstante rastvorljivosti je ista sa jedinicom koncentracije rastvorka. Za saharozu K = 1.971 mol dm−3 na 25 °C. Ovim se pokazuje da je rastvorljivost suharoze na 25 °C skoro 2 mol dm−3 (540 g/l). Saharoza je neobična po tome što ne formira lako superzasićeni rastvor na višim koncentracijama, za razliku od drugih ugljenih hidrata.
Jonska jedinjenja se normalno disociraju u njihove konstituentne jone pri rastvaranju u vodi. Na primer, za kalcijum-sulfat važi:
Kao i u prethodnom primeru, jednačina ravnoteže je:
gde je K![]() termodinamička ravnotežna konstanta, a zagrade označavaju aktivnost. Aktivnost čiste čvrste materije je po definiciji jednaka jedinici.
termodinamička ravnotežna konstanta, a zagrade označavaju aktivnost. Aktivnost čiste čvrste materije je po definiciji jednaka jedinici.
Kad je rastvorljivost soli veoma niska koeficijenti aktivnosti jona u rastvoru su skoro jednaki jedinici. Ako se uzme da je njihova vrednost jedan, jednačina postajeproizvod rastvorljivosti:
Proizvod rastvorljivosti opšteg binarnog jedinjenja ApBq je
- ApBq
 pAq+ + qBp-
pAq+ + qBp- - Ksp = [A]p[B]q (električni naboji su izostavljeni da bi se pojednostavila notacija)
Kad dođe do disocijacije, koncentracija B je jednaka q/p koncentracije A.
- [B] = q/p [A]
Stoga je:
- Ksp = [A]p (q/p)q [A]q = (q/p)q × [A]p+q
![[A] = \sqrt[p+q]{K_{\mathrm{sp}} \over {(q/p)^q}}](https://upload.wikimedia.org/math/a/e/7/ae768b1147273c132edfc303a075f12e.png)
Rastvorljivost, S je 1/p [A]. To se može uzeti u obzir:
Primeri:
- CaSO4: p=1, q=1,

- Na2SO4: p=2, q=1,
![S=\sqrt[3]{K_{sp}\over4}](https://upload.wikimedia.org/math/2/8/6/2864e6560d153dc1958724c5b277e999.png)
- Al2(SO4)3: p=2, q=3,
![S=\sqrt[5]{K_{sp}\over 108}](https://upload.wikimedia.org/math/b/b/8/bb8c1ca455651ad6a48ad570245bca80.png)
Proizvodi rastvorljivosti se često izražavaju u logaritamskom obliku. Tako je za kalcijum sulfat, Ksp = 4.93-5, log Ksp = -4.32. Što je manja vrednost, ili što je negativnija log vrednost, to je niža rastvorljivost.
Neke soli nisu potpuno rastvorene u rastvoru. Primer takve soli je MgSO4.[9] Njihova rastvorljivost se računa metodom za rastvaranje sa reakcijom.
Proizvod rastvorljivosti hidroksida se često daje u modifikovanom obliku, K*sp, koristeći koncentraciju vodonikovih jona umesto hidroksilnih jona.[10] Ove dve koncentracije su povezane konstantom samo jonizacije vode, Kw.
- Kw=[H+][OH–]
Na primer,
- Ca(OH)2
 Ca2+ + 2 OH–
Ca2+ + 2 OH– - Ksp = [Ca2+][OH–]2 = [Ca2+]Kw2[H+]-2
- K*sp = Ksp/Kw2 = [Ca2+][H+]-2
log Ksp za Ca(OH)2 je oko -5 na sobnoj temperaturi; log K*sp = -5 + 2 × 14 = 23, aproksimativno.
Uticaj zajedničkog jona je smanjenje rastvorljivosti jedne soli, kada je druga so koja ima zajednički jon, prisutna. Na primer, rastvorljivost srebro hlorida, AgCl, je niža kad se natrijum hlorid doda u suspensiju AgCl u vodi.[11]
- AgCl(s)
 Ag+(aq) + Cl–(aq); Ksp = [Ag+][Cl–]
Ag+(aq) + Cl–(aq); Ksp = [Ag+][Cl–]
Rastvorljivost, S, u odsustvu zajedničkog jona se može izračunati na sledeći način. Koncentracije [Ag+] i [Cl–] su jednake jer jedan mol AgCl disocira u jedan mol Ag+ i jedan mol Cl–. Ako se koncentracije [Ag+](aq) označe sa x.
- Ksp = x2; S = x =

Ksp za AgCl je 1.77-10 mol2dm−6 na 25 °C, tako da je rastvorljivost 1.33-5 mol dm−3.
Sad pretpostavimo da je natrijum hlorid takođe prisutan, sa koncentracijom od 0.01 mol dm−3. Rastvorljivost, ignorišući ostale moguće uticaje jona natrijuma, se sad računa kao
- Ksp = x(0.01 + x)
Ovo je kvadratna jednačina po x, koji je isto toko jednak sa rastvorljivošću.
- x2 + 0.01 x – Ksp = 0
U slučaju srebro hlorida x2 je znato manje od 0.01 x, tako da se taj član može izostaviti. Stoga je
- S = x = Ksp / 0.01 = 1.77-8 mol dm-3,
znatno umanjena. U gravimetrijskoj analizi srebra, umanjenje rastvorljivosti usled uticaja zajedničkog jona se koristi za ostvarivanje kompletne precipitacije AgCl.
Tipična reakcija ove klase je rastvaranje slabe baze, B, u kiselom vodenom rastvoru.
- B(s) + H+ (aq)
 BH+ (aq)
BH+ (aq)
Ova reakcija je važna za farmaceutske proizvode.[12] Rastvaranje slabih kiselina u alkalnoj sredini je takođe važno.
- HnA(s) + OH–(aq)
 Hn-1A–(aq) + H2O
Hn-1A–(aq) + H2O
Nenaelektrisani molekul obično ima nižu rastvorljivost od jonizovanog oblika, tako da rastvorljivost zavisi od pH i konstante disocijacije kiseline rastvorka. Termin „unutrašnja rastvorljivost“ se koristi za opisivanje rastvorljivosti nejonizovanog oblika u odsustvu kiseline ili baze.
Izdvajanje aluminijumskih soli iz stena i zemljišta kiselom kišom je još jedan primer solvatacije: aluminosilikati su baze koje reaguju sa kiselinom da formiraju rastvorne oblike, kao što je Al3+(aq).
Formiranje hemijskih kompleksa isto tako može da utiče na rastvorljivost. Dobro poznati primer je dodavanje koncentrovanog rastvora amonijaka u suspenziju srebro hlorida, pri čemu dolazi do rastvaranja usled formiranja aminskog kompleksa.
- AgCl(s) +2 NH3(aq)
 [Ag(NH3)2]+ (aq) + Cl– (aq)
[Ag(NH3)2]+ (aq) + Cl– (aq)
Još jedan primer je dodavanje omekšivača vode u prašak za pranje da bi se inhibirala precipitacija soli magnezijuma i kalcijuma, koje su prisutne u tvrdoj vodi, putem formiranja kompleksa sa njima.
Za izračunavanje rastvorljivosti u ovim slučajevima neohodno je da se razmatraju dve ili više simultanih ravnoteža. Na primer,
-
Ravnoteža unutrašnje rastvorljivosti B(s)  B(aq): Ks = [B(aq)]
B(aq): Ks = [B(aq)]Kiselo-bazna ravnoteža B(aq) + H+(aq)  BH+(aq) Ka = [B(aq)][H+(aq)]/[BH+(aq)]
BH+(aq) Ka = [B(aq)][H+(aq)]/[BH+(aq)]




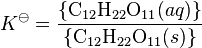
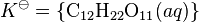
![K_s = \left[\mathrm{{C}_{12}{H}_{22}{O}_{11}}(aq)\right]\,](https://upload.wikimedia.org/math/1/b/f/1bf337b3d2df2d123234dd50f9b7e37e.png)

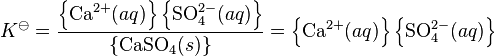
![K_{\mathrm{sp}} = \left[\mbox{Ca}^{2+}(aq)\right]\left[\mbox{SO}_4^{2-}(aq)\right].\,](https://upload.wikimedia.org/math/9/f/9/9f9d19ff487322a888ed709ef071964b.png)
![S = {[A] \over p} = {[B] \over q} = \sqrt[p+q]{K_{\mathrm{sp}} \over {(q/p)^q} p^{p+q}} = \sqrt[p+q]{K_{\mathrm{sp}} \over {q^q} p^p}](https://upload.wikimedia.org/math/1/e/5/1e51ee7708b566e2b08d581f7bdabddb.png)

